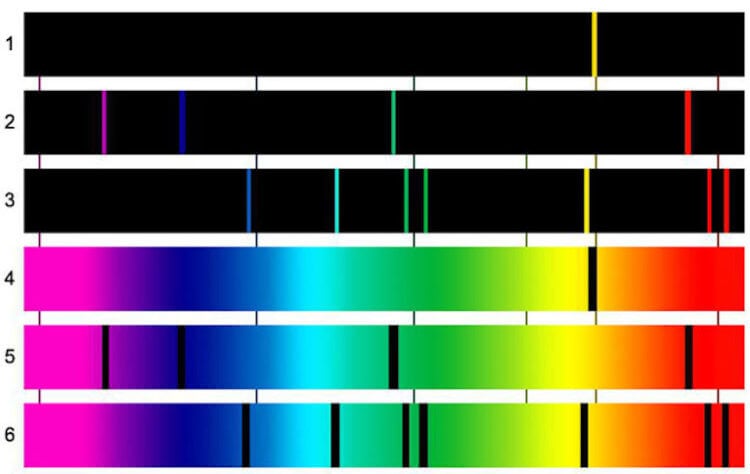
Какого металла больше всего во Вселенной
Самым распространенным химическим элементом на нашей планете является углерод. Но в масштабах Вселенной Земля — лишь песчинка среди бескрайнего моря звезд и галактик. И в связи с этим становится интересным, а из чего состоит наша Вселенная? Что является основой далеких планет и астероидов? Какой элемент периодической таблицы самый главный?
Самый распространенный химический элемент во Вселенной
Если говорить о том, какой элемент самый распространенный во Вселенной, то тут все будет очень просто. На первом месте идет водород, затем гелий, кислород, неон и замыкает пятерку лидеров железо. А теперь давайте подумаем, какой элемент выбивается из общей картины.
Правильно! Железо! Почему? Да потому, что все остальные представители таблицы Менделеева, кроме железа, являются газами. А железо — это металл. Таким образом железо — это самый распространенный металл во всей Вселенной. При этом он и один из самых важных, ведь если газы формируют в основном атмосферу небесных тел, то железо является основой планет. А значит можно сказать, что если бы не было железа, то не было бы и большинства объектов во Вселенной.
Как ученые определили, что железо — самый распространенный металл во Вселенной
По сообщению журнала The Astrophysical Journal, группа астрохимиков из США пришла к такому выводу, рассчитав спектр поглощения кластеров железа. То есть ученые провели спектральный анализ удаленных объектов. Если не вдаваться в подробности, то объяснить это можно следующим образом.
Когда мы что-либо видим, это означает, что от этого объекта отражается свет и мы улавливаем эти световые волны. Свет – это смесь электромагнитных колебаний, и каждое колебание имеет свою длину волны, и, соответственно, свой цвет. Есть 7 основных цветов, а также оттенков и переходов между ними. Когда проводится спектральный анализ, изучается именно то, как химические элементы поглащают или отражают свет. В итоге получается спектрограмма. На основе получившейся картины можно сделать вывод о характеристиках испустившего свет объекта. Простой пример — радуга после дождя. Капли дождя разделяют свет, исходящий от Солнца.
Где находится «космическое железо»
Большая часть железа Вселенной сконцентрирована внутри планет и в межзвездном газе. Кроме того, как показывает новое исследование, не мало железа находится в связи с углеродом, формируя особые молекулы, называемые полиинами. При этом ранее предполагалось, что эти самые полиины — это соединения углерода без примесей железа.
«Атомы железа объединяются в особые соединения с углеродом и основная проблема в том, что эти соединения имеют почти такой же спектр, что и чистые углеводороды. Поэтому ранее мы могли легко их проглядеть», — говорит ведущий автор исследования Фрэнк Тиммес
Хотите узнать что-то новое? Подписывайтесь на наш канал в Яндекс.Дзен. Там регулярно выходят материалы, которых не найти на сайте.
Источник
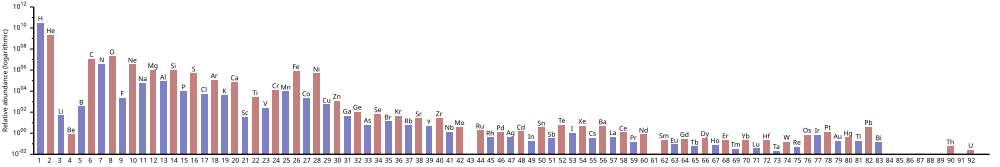
Топ-10: самые распространенные химические элементы во всей Вселенной
Все мы знаем, что водород наполняет нашу Вселенную на 75%. Но знаете ли вы, какие еще есть химические элементы, не менее важные для нашего существования и играющие значительную роль для жизни людей, животных, растений и всей нашей Земли? Элементы из этого рейтинга формируют всю нашу Вселенную!
10. Сера (распространенность относительно кремния – 0.38)

Этот химический элемент в таблице Менделеева значится под символом S и характеризуется атомным номером 16. Сера очень распространена в природе.
9. Железо (распространенность относительно кремния – 0.6)
Обозначается символом Fe, атомный номер – 26. Железо очень часто встречается в природе, особенно важную роль оно играет в формировании внутренней и внешней оболочки ядра Земли.
8. Магний (распространенность относительно кремния – 0.91)

В таблице Менделеева магний можно найти под символом Mg, и его атомный номер – 12. Что самое удивительное в этом химическом элементе, так это то, что он чаще всего выделяется при взрыве звезд в процессе их преобразования в сверхновые тела.
7. Кремний (распространенность относительно кремния – 1)

Обозначается как Si. Атомный номер кремния – 14. Этот серо-голубой металлоид очень редко встречается в земной коре в чистом виде, но довольно распространен в составе других веществ. Например, его можно обнаружить даже в растениях.
6. Углерод (распространенность относительно кремния – 3.5)
Углерод в таблице химических элементов Менделеева значится под символом С, его атомный номер – 6. Самой знаменитой аллотропной модификацией углерода являются одни из самых желанных драгоценных камней в мире – алмазы. Углерод активно применяют и в других в промышленных целях более будничного назначения.
5. Азот (распространенность относительно кремния – 6.6)

Символ N, атомный номер 7. Впервые открытый шотландским врачом Дэниелом Рутерфордом (Daniel Rutherford), азот чаще всего встречается в форме азотной кислоты и нитратов.
4. Неон (распространенность относительно кремния – 8.6)
Обозначается символом Ne, атомный номер — 10. Не секрет, что именно этот химический элемент ассоциируется с красивым свечением.
3. Кислород (распространенность относительно кремния – 22)

Химический элемент под символом О и с атомным номером 8, кислород незаменим для нашего существования! Но это не значит, что он присутствует только на Земле и служит только для человеческих легких. Вселенная полна сюрпризов.
2. Гелий (распространенность относительно кремния – 3.100)

Символ гелия – He, атомный номер – 2. Он бесцветен, не имеет запаха и вкуса, не ядовит, и его точка кипения – самая низкая среди всех химических элементов. А еще благодаря ему шарики взмывают ввысь!
1. Водород (распространенность относительно кремния – 40.000)
Истинный номер один в нашем списке, водород находится в таблице Менделеева под символом Н и обладает атомным номером 1. Это самый легкий химический элемент периодической таблицы и самый распространенный элемент во всей изученной человеком Вселенной.
Источник
Разнообразие химических элементов во Вселенной
Современная таблица Менделеева содержит 118 химических элементов. Согласно истории Вселенной, после Большого взрыва образовались только четыре элемента: водород, гелий и малое вкрапление лития и бериллия, а также один из изотопов водорода — дейтерий. Вселенной понадобилось почти 13,8 миллиарда лет, чтобы прийти к современному составу. Как получились более тяжëлые элементы?
Часть элементов образуется в процессе эволюции звёзд. Выделение энергии в звезде осуществляется за счёт протекания термоядерных реакций, при которых лёгкие атомные ядра объединяются в более тяжëлые. Здесь есть зависимость от массы, например, в звезде средней массы (такой, как Солнце) на протяжении нескольких миллиардов лет будут идти реакции превращения водорода в гелий, после чего часть гелия идёт на синтез кислорода и углерода, но дальнейшие реакции происходить не будут. Более массивные звёзды способны образовать в своих недрах неон, магний, кремний, серу, никель, кремний, железо. Однако в звёздах невозможно образование элементов тяжелее железа, так как такие реакции требуют дополнительной энергии.
Существуют элементы с атомным номером больше 38, такие как вольфрам, ртуть, свинец, которые образовались в звёздах с массой до трёх масс Солнца. Однако это не термоядерные реакции, которые поддерживают тепловыделение. При высокой температуре внутри звезды ядро атома захватывает нейтрон. Затем в ядре происходит бета-распад, при этом образуется протон, и атомный номер ядра возрастает. Это так называемый s-процесс (от английского slow), который не основной в звезде, скорее протекает как побочный эффект звёздной эволюции.
Какие ещё высокоэнергетические процессы происходят во Вселенной? Например, взрыв сверхновой, при котором за несколько месяцев выделяется энергия, которая выделилась бы на Солнце за 30 миллиардов лет (если бы оно столько существовало). Взрыв сверхновой — это конец жизни звезды, и в его процессе в окружающее пространство выбрасываются элементы, которые синтезировались в звезде. Сверхновая I типа — это взрыв белого карлика, который входит в двойную систему, сверхновая II типа — это взрыв массивной звезды. В первом случае образуются элементы с атомным номером 14-30, а при взрыве сверхновой II-го типа образуется множество элементов, вплоть до циркония с атомным номером 40.
Более тяжёлые элементы образуются в процессе слияния двух нейтронных звёзд. Этот процесс называют «килоновой». При слиянии вещество нагревается до миллиардов градусов, и при этом образуются элементы вплоть до плутония. Каждое подобное событие рождает огромное количество золота и платины, примерно 200 и 500 масс Земли, а также других благородных и радиоактивных металлов. Да, ваши золотые украшения образовались при слиянии нейтронных звëзд.
Существуют ещё так называемые реакции скалывания, в которых образуется литий, бериллий и бор. Это расщепление более тяжёлых элементов (кислород, азот, углерод), которые подвергаются воздействию высокоэнергетических заряженных частиц, например, протонов. Когда частица сталкивается с тяжёлым ядром, она выбивает из него ядро лёгкого элемента. Такие реакции происходят во внешних частях звёзд на раннем этапе эволюции, в верхней атмосфере Земли и на её поверхности, а также в межзвёздной среде.
Все элементы тяжелее плутония синтезировал человек на ускорителях частиц. Они радиоактивны и нестабильны. Часть этих элементов открыли на российском ускорителе Объединенного института ядерных исследований.
Всего на данный момент только 2% изначального водорода и гелия трансформировались в более тяжёлые элементы.
Источник
Обилие химических элементов — Abundance of the chemical elements
Обилие химических элементов является мерой возникновения из химических элементов относительно всех других элементов в данной среде. Численность измеряется одним из трех способов: массовая доля (то же, что и массовая доля); по мольной доле (доля атомов в числовом исчислении, а иногда и доля молекул в газах); или по объемной доле . Объемная доля — это обычная мера содержания в смешанных газах, таких как атмосферы планет, и аналогична по величине молекулярной мольной доле для газовых смесей при относительно низких плотностях и давлениях, а также в идеальных газовых смесях. Большинство значений численности в этой статье даны в массовых долях.
Например, содержание кислорода в чистой воде можно измерить двумя способами: массовая доля составляет около 89%, потому что это доля массы воды, которая является кислородом. Однако мольная доля составляет около 33%, потому что только 1 атом из 3 в воде, H 2 O, является кислородом. В качестве другого примера, глядя на масс-фракции обилие водорода и гелия в обоих Вселенной в целом и в атмосфере из газовых гигантских планет , таких как Юпитер , это 74% для водорода и 23-25% для гелия ; в то время как (атомная) мольная доля водорода в этих средах составляет 92%, а гелия — 8%. Изменение данной среды на внешнюю атмосферу Юпитера , где водород двухатомный, а гелий нет, изменяет молекулярную мольную долю (долю от общего количества молекул газа), а также долю атмосферы по объему водорода примерно до 86%, и гелия до 13%.
Изобилие химических элементов во Вселенной определяется большим количеством водорода и гелия, которые были произведены в результате Большого взрыва . Остальные элементы, составляющие лишь около 2% Вселенной, в основном были произведены сверхновыми и некоторыми красными звездами-гигантами . Литий , бериллий и бор встречаются редко, потому что, хотя они производятся в результате ядерного синтеза, они затем разрушаются другими реакциями в звездах. Элементов от углерода до железа относительно больше во Вселенной из-за простоты их получения в процессе нуклеосинтеза сверхновых . Элементы с более высоким атомным номером, чем железо (элемент 26), становятся все более редкими во Вселенной, потому что при их производстве они все больше поглощают звездную энергию. Кроме того, элементы с четными атомными номерами обычно более распространены, чем их соседи в периодической таблице , из-за благоприятной энергетики образования.
Обилие элементов на Солнце и на внешних планетах такое же, как и во Вселенной. Из-за солнечного нагрева элементы Земли и внутренних каменистых планет Солнечной системы претерпели дополнительное истощение летучих водорода, гелия, неона, азота и углерода (который улетучивается в виде метана). Кора, мантия и ядро Земли демонстрируют признаки химической сегрегации плюс некоторая секвестрация по плотности. Более легкие силикаты алюминия находятся в коре, больше силиката магния в мантии, в то время как металлическое железо и никель составляют ядро. Обилие элементов в специализированных средах, таких как атмосфера, океаны или человеческое тело, в первую очередь является продуктом химического взаимодействия со средой, в которой они находятся.
СОДЕРЖАНИЕ
Вселенная
| Z | Элемент | Массовая доля (ppm) |
|---|---|---|
| 1 | Водород | 739 000 |
| 2 | Гелий | 240 000 |
| 8 | Кислород | 10 400 |
| 6 | Углерод | 4600 |
| 10 | Неон | 1,340 |
| 26 год | Утюг | 1,090 |
| 7 | Азот | 960 |
| 14 | Кремний | 650 |
| 12 | Магний | 580 |
| 16 | Сера | 440 |
| Общее | 999 500 |
Элементы, то есть обычная ( барионная ) материя, состоящая из протонов , нейтронов и электронов , составляют лишь небольшую часть содержимого Вселенной . Космологические наблюдения показывают, что только 4,6% энергии Вселенной (включая массу, вносимую энергией, E = mc² ↔ m = E / c²) составляет видимую барионную материю, из которой состоят звезды , планеты и живые существа. Остальное, как полагают, состоит из темной энергии (68%) и темной материи (27%). Это формы материи и энергии, которые, как считается, существуют на основе научной теории и индуктивных рассуждений, основанных на наблюдениях, но они не наблюдались напрямую, и их природа не совсем понятна.
Наиболее стандартная (барионная) материя находится в межгалактическом газе, звездах и межзвездных облаках в форме атомов или ионов ( плазма ), хотя ее можно найти в вырожденных формах в экстремальных астрофизических условиях, таких как высокие плотности внутри белых карликов. и нейтронные звезды .
Водород — самый распространенный элемент во Вселенной; гелий на втором месте. Однако после этого ранг изобилия больше не соответствует порядковому номеру ; кислород имеет степень распространенности 3, но атомный номер 8. Все остальные встречаются значительно реже.
Обилие самых легких элементов хорошо предсказывается стандартной космологической моделью , поскольку они в основном образовались вскоре (то есть в течение нескольких сотен секунд) после Большого взрыва в процессе, известном как нуклеосинтез Большого взрыва . Более тяжелые элементы в основном были произведены гораздо позже, внутри звезд .
По оценкам, водород и гелий составляют примерно 74% и 24% всей барионной материи во Вселенной соответственно. Несмотря на то, что они составляют лишь очень небольшую часть Вселенной, оставшиеся «тяжелые элементы» могут сильно влиять на астрономические явления. Только около 2% (по массе) диска галактики Млечный Путь состоит из тяжелых элементов.
Эти другие элементы создаются звездными процессами. В астрономии «металл» — это любой элемент, кроме водорода или гелия. Это различие важно, потому что водород и гелий — единственные элементы, которые были произведены в значительных количествах во время Большого взрыва. Таким образом, Металличность из галактики или другого объекта является показателем звездной активности после Большого взрыва.
В общем, элементы вплоть до железа образуются в больших звездах в процессе превращения в сверхновые . Железо-56 особенно распространено, так как это наиболее стабильный нуклид (в том смысле, что он имеет самую высокую ядерную энергию связи на нуклон) и может быть легко получен из альфа-частиц (являясь продуктом распада радиоактивного никеля-56 , в конечном итоге полученного из 14 ядер гелия). Элементы тяжелее железа образуются в процессах поглощения энергии в крупных звездах, и их содержание во Вселенной (и на Земле) обычно уменьшается с увеличением атомного номера.
Солнечная система
| Нуклид | А | Массовая доля в миллионных долях | Фракция атома в миллионных долях |
|---|---|---|---|
| Водород-1 | 1 | 705 700 | 909 964 |
| Гелий-4 | 4 | 275 200 | 88 714 |
| Кислород-16 | 16 | 9 592 | 477 |
| Углерод-12 | 12 | 3032 | 326 |
| Азот-14 | 14 | 1,105 | 102 |
| Неон-20 | 20 | 1,548 | 100 |
 | |||
| Другие нуклиды: | 3 879 | 149 | |
| Кремний-28 | 28 год | 653 | 30 |
| Магний-24 | 24 | 513 | 28 год |
| Утюг-56 | 56 | 1,169 | 27 |
| Сера-32 | 32 | 396 | 16 |
| Гелий-3 | 3 | 35 год | 15 |
| Водород-2 | 2 | 23 | 15 |
| Неон-22 | 22 | 208 | 12 |
| Магний-26 | 26 год | 79 | 4 |
| Углерод-13 | 13 | 37 | 4 |
| Магний-25 | 25 | 69 | 4 |
| Алюминий-27 | 27 | 58 | 3 |
| Аргон-36 | 36 | 77 | 3 |
| Кальций-40 | 40 | 60 | 2 |
| Натрий-23 | 23 | 33 | 2 |
| Утюг-54 | 54 | 72 | 2 |
| Кремний-29 | 29 | 34 | 2 |
| Никель-58 | 58 | 49 | 1 |
| Кремний-30 | 30 | 23 | 1 |
| Утюг-57 | 57 год | 28 год | 1 |
Следующий график (шкала журнала заметок) показывает изобилие элементов в Солнечной системе . В таблице показаны двенадцать наиболее распространенных элементов в нашей галактике (оцененные спектроскопически), измеренные в частях на миллион по массе. Близлежащие галактики, которые развивались по аналогичным направлениям, имеют соответствующее обогащение элементами более тяжелыми, чем водород и гелий. Более далекие галактики рассматриваются такими, какими они были в прошлом, поэтому их содержание элементов кажется более близким к изначальной смеси. Однако, поскольку физические законы и процессы единообразны во всей Вселенной, ожидается, что и в этих галактиках будет одинаковое количество элементов.
Обилие элементов соответствует их происхождению от Большого взрыва и нуклеосинтеза в ряде звезд- прародителей сверхновых . Очень распространенные водород и гелий являются продуктами Большого взрыва, в то время как следующие три элемента встречаются редко, поскольку у них было мало времени, чтобы сформироваться во время Большого взрыва, и они не образуются в звездах (однако они производятся в небольших количествах в результате распада более тяжелых элементов). элементы в межзвездной пыли в результате воздействия космических лучей ).
Начиная с углерода, элементы были произведены в звездах путем накопления из альфа-частиц (ядер гелия), что привело к попеременно большему количеству элементов с четными атомными номерами (они также более стабильны). Эффект того, что химические элементы с нечетными номерами, обычно более редкие во Вселенной, были эмпирически замечены в 1914 году и известны как правило Оддо-Харкинса .
Связь с ядерной энергией связи
Наблюдалась слабая корреляция между оценкой содержания элементов во Вселенной и кривой энергии связи ядер . Грубо говоря, относительная стабильность различных атомных нуклидов оказала сильное влияние на относительное содержание элементов, образовавшихся в результате Большого взрыва , а затем во время развития Вселенной. См. Статью о нуклеосинтезе для объяснения того, как определенные процессы ядерного синтеза в звездах (например, сжигание углерода и т. Д.) Создают элементы тяжелее водорода и гелия.
Еще одна наблюдаемая особенность — неровное чередование относительного содержания и дефицита соседних атомных номеров на кривой содержания элементов и аналогичная картина уровней энергии на кривой энергии связи ядер. Это чередование вызвано более высокой относительной энергией связи (соответствующей относительной стабильности) четных атомных номеров по сравнению с нечетными атомными номерами и объясняется принципом исключения Паули . Массовая формула полуэмпирическое (SEMF), также называемая формула Вейцзеккера или массовая формула Бете-Вайцзекер , дает теоретическое объяснение общей формы кривой ядерной энергии связи.
земля
Земли образуются из того же облака материи, образованное Солнце, но планеты приобрели различные композиции в процессе формирования и эволюции Солнечной системы . В свою очередь, естественная история Земли привела к тому, что части этой планеты имели разную концентрацию элементов.
Масса Земли составляет примерно 5,98 × 10 24 кг. В массе он состоит в основном из железа (32,1%), кислорода (30,1%), кремния (15,1%), магния (13,9%), серы (2,9%), никеля (1,8%), кальция (1,5 %). %) и алюминия (1,4%); оставшиеся 1,2% составляют следовые количества других элементов.
Основной состав Земли по элементарной массе примерно аналогичен валовому составу Солнечной системы, с основными отличиями в том, что на Земле отсутствует большое количество летучих элементов — водорода, гелия, неона и азота, а также углерод, который был утерян в виде летучих углеводородов. Остающийся элементный состав примерно типичен для «каменистых» внутренних планет, которые образовались в тепловой зоне, где солнечное тепло вытеснило летучие соединения в космос. Земля сохраняет кислород как второй по величине компонент своей массы (и наибольшую атомную долю), в основном из-за того, что этот элемент удерживается в силикатных минералах, которые имеют очень высокую температуру плавления и низкое давление пара.
| Атомный номер | Имя | Символ | Массовая доля (ppm) | Атомная доля (ppb) |
|---|---|---|---|---|
| 8 | кислород | О | 297000 | 482 000 000 |
| 12 | магний | Mg | 154000 | 164 000 000 |
| 14 | кремний | Si | 161000 | 150 000 000 |
| 26 год | утюг | Fe | 319000 | 148 000 000 |
| 13 | алюминий | Al | 15900 | 15 300 000 |
| 20 | кальций | Ca | 17100 | 11 100 000 |
| 28 год | никель | Ni | 18220 | 8 010 000 |
| 1 | водород | ЧАС | 260 | 6 700 000 |
| 16 | сера | S | 6350 | 5 150 000 |
| 24 | хром | Cr | 4700 | 2 300 000 |
| 11 | натрий | Na | 1800 | 2 000 000 |
| 6 | углерод | C | 730 | 1,600,000 |
| 15 | фосфор | п | 1210 | 1 020 000 |
| 25 | марганец | Mn | 1700 | 800 000 |
| 22 | титан | Ti | 810 | 440 000 |
| 27 | кобальт | Co | 880 | 390 000 |
| 19 | калий | K | 160 | 110 000 |
| 17 | хлор | Cl | 76 | 56 000 |
| 23 | ванадий | V | 105 | 53 600 |
| 7 | азот | N | 25 | 46 000 |
| 29 | медь | Cu | 60 | 25 000 |
| 30 | цинк | Zn | 40 | 16 000 |
| 9 | фтор | F | 10 | 14 000 |
| 21 год | скандий | Sc | 11 | 6 300 |
| 3 | литий | Ли | 1,10 | 4 100 |
| 38 | стронций | Sr | 13 | 3 900 |
| 32 | германий | Ge | 7.00 | 2,500 |
| 40 | цирконий | Zr | 7.10 | 2 000 |
| 31 год | галлий | Ga | 3,00 | 1,000 |
| 34 | селен | Se | 2,70 | 890 |
| 56 | барий | Ба | 4,50 | 850 |
| 39 | иттрий | Y | 2,90 | 850 |
| 33 | мышьяк | В виде | 1,70 | 590 |
| 5 | бор | B | 0,20 | 480 |
| 42 | молибден | Пн | 1,70 | 460 |
| 44 год | рутений | RU | 1,30 | 330 |
| 78 | платина | Pt | 1,90 | 250 |
| 46 | палладий | Pd | 1,00 | 240 |
| 58 | церий | Ce | 1.13 | 210 |
| 60 | неодим | Nd | 0,84 | 150 |
| 4 | бериллий | Быть | 0,05 | 140 |
| 41 год | ниобий | Nb | 0,44 | 120 |
| 76 | осмий | Операционные системы | 0,90 | 120 |
| 77 | иридий | Ir | 0,90 | 120 |
| 37 | рубидий | Руб. | 0,40 | 120 |
| 35 год | бром | Br | 0,30 | 97 |
| 57 год | лантан | Ла | 0,44 | 82 |
| 66 | диспрозий | Dy | 0,46 | 74 |
| 64 | гадолиний | Б-г | 0,37 | 61 |
| 52 | теллур | Te | 0,30 | 61 |
| 45 | родий | Rh | 0,24 | 61 |
| 50 | банка | Sn | 0,25 | 55 |
| 62 | самарий | См | 0,27 | 47 |
| 68 | эрбий | Э | 0,30 | 47 |
| 70 | иттербий | Yb | 0,30 | 45 |
| 59 | празеодим | Pr | 0,17 | 31 год |
| 82 | Свинец | Pb | 0,23 | 29 |
| 72 | гафний | Hf | 0,19 | 28 год |
| 74 | вольфрам | W | 0,17 | 24 |
| 79 | золото | Au | 0,16 | 21 год |
| 48 | кадмий | CD | 0,08 | 18 |
| 63 | европий | Евросоюз | 0,10 | 17 |
| 67 | гольмий | Хо | 0,10 | 16 |
| 47 | серебро | Ag | 0,05 | 12 |
| 65 | тербий | Tb | 0,07 | 11 |
| 51 | сурьма | Sb | 0,05 | 11 |
| 75 | рений | Re | 0,08 | 10 |
| 53 | йод | я | 0,05 | 10 |
| 69 | тулий | Тм | 0,05 | 7 |
| 55 | цезий | CS | 0,04 | 7 |
| 71 | лютеций | Лу | 0,05 | 7 |
| 90 | торий | Чт | 0,06 | 6 |
| 73 | тантал | Та | 0,03 | 4 |
| 80 | Меркурий | Hg | 0,02 | 3 |
| 92 | уран | U | 0,02 | 2 |
| 49 | индий | В | 0,01 | 2 |
| 81 год | таллий | Tl | 0,01 | 2 |
| 83 | висмут | Би | 0,01 | 1 |
Корка
Массовая доля девяти наиболее распространенных элементов в земной коре составляет приблизительно: кислород 46%, кремний 28%, алюминий 8,3%, железо 5,6%, кальций 4,2%, натрий 2,5%, магний 2,4%, калий 2,0% и титан 0,61%. Остальные элементы составляют менее 0,15%. Для получения полного списка см. Обилие элементов в земной коре .
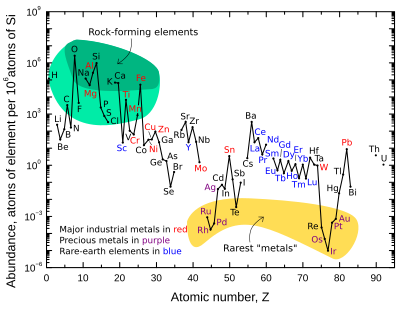
График справа показывает относительное содержание атомов химических элементов в верхней части континентальной коры Земли — части, которая относительно доступна для измерений и оценок.
Многие из элементов, показанных на графике, подразделяются на (частично перекрывающиеся) категории:
- породообразующие элементы (основные элементы в зеленом поле и второстепенные элементы в светло-зеленом поле);
- редкоземельные элементы (лантаноиды, La-Lu, Sc и Y; отмечены синим);
- основные промышленные металлы (мировое производство>
3 × 10 7 кг / год; отмечены красным);
Обратите внимание, что есть два разрыва, где будут находиться нестабильные (радиоактивные) элементы технеций (атомный номер 43) и прометий (атомный номер 61). Эти элементы окружены стабильными элементами, но оба имеют относительно короткий период полураспада (
4 миллиона лет и
18 лет соответственно). Таким образом, они крайне редки, поскольку любые их изначальные первоначальные фракции в материалах до Солнечной системы давно распались. Эти два элемента теперь производятся естественным путем только в результате спонтанного деления очень тяжелых радиоактивных элементов (например, урана , тория или следовых количеств плутония, которые присутствуют в урановых рудах) или в результате взаимодействия некоторых других элементов с космическими лучами . И технеций, и прометий были идентифицированы спектроскопически в атмосферах звезд, где они производятся в ходе продолжающихся процессов нуклеосинтеза.
На графике содержания также есть изломы там, где должны были бы находиться шесть благородных газов , поскольку они не связаны химически в земной коре и генерируются в коре только цепочками распада радиоактивных элементов и поэтому встречаются там крайне редко.
Восемь встречающихся в природе очень редких высокорадиоактивных элементов ( полоний , астат , франций , радий , актиний , протактиний , нептуний и плутоний ) не включены, так как любой из этих элементов, которые присутствовали при формировании Земли, распались эоны назад, а сегодня их количество незначительно и производится только в результате радиоактивного распада урана и тория.
Кислород и кремний — самые распространенные элементы земной коры. На Земле и вообще на каменистых планетах кремний и кислород встречаются гораздо чаще, чем их космическое количество. Причина в том, что они соединяются друг с другом, образуя силикатные минералы . Другие распространенные в космосе элементы, такие как водород , углерод и азот, образуют летучие соединения, такие как аммиак и метан, которые легко улетучиваются в космос из-за высокой температуры образования планет и / или солнечного света.
Редкоземельные элементы
«Редкие» элементы земли — историческое неправильное название. Постоянство этого термина отражает скорее незнакомость, чем истинную редкость. Более распространенные редкоземельные элементы аналогичным образом сконцентрированы в коре по сравнению с обычными промышленными металлами, такими как хром, никель, медь, цинк, молибден, олово, вольфрам или свинец. Два наименее распространенных редкоземельных элемента ( тулий и лютеций ) встречаются почти в 200 раз чаще, чем золото . Однако, в отличие от обычных цветных и драгоценных металлов, редкоземельные элементы имеют очень небольшую тенденцию к концентрации в пригодных для использования рудных месторождениях. Следовательно, большая часть мировых запасов редкоземельных элементов поступает только из нескольких источников. Кроме того, все редкоземельные металлы очень похожи друг на друга по химическому составу, и поэтому их довольно трудно разделить на количества чистых элементов.
Различия в содержании отдельных редкоземельных элементов в верхней континентальной коре Земли представляют собой суперпозицию двух эффектов: ядерного и геохимического. Во-первых, редкоземельные элементы с четными атомными номерами ( 58 Ce, 60 Nd, . ) имеют большее космическое и земное содержание, чем соседние редкоземельные элементы с нечетными атомными номерами ( 57 La, 59 Pr, . ). Во-вторых, более легкие редкоземельные элементы более несовместимы (потому что они имеют больший ионный радиус) и поэтому более сильно сконцентрированы в континентальной коре, чем более тяжелые редкоземельные элементы. В большинстве месторождений редкоземельных руд первые четыре редкоземельных элемента — лантан , церий , празеодим и неодим — составляют от 80% до 99% от общего количества редкоземельного металла, который может быть найден в руде.
Мантия
Массовая доля восьми самых распространенных элементов в мантии Земли (см. Основную статью выше) составляет приблизительно: кислород 45%, магний 23%, кремний 22%, железо 5,8%, кальций 2,3%, алюминий 2,2%, натрий 0,3%. , калий 0,3%.
Основной
В связи с массовой сегрегации , ядро Земли , как полагают, в основном состоит из железа (88,8%), с меньшим количеством никеля (5,8%), серы (4,5%), и менее чем 1% микроэлементов.
Океан
Самыми распространенными элементами в океане по массе в процентах являются кислород (85,84%), водород (10,82%), хлор (1,94%), натрий (1,08%), магний (0,13%), сера (0,09%), кальций (0,04%), калий (0,04%), бром (0,007%), углерод (0,003%) и бор (0,0004%).
Атмосфера
Порядок элементов в атмосфере по объемной доле (что примерно соответствует молекулярной доле) : азот (78,1%), кислород (20,9%), аргон (0,96%), за которым следуют (в неопределенном порядке) углерод и водород, потому что водяной пар и углекислый газ, которые представляют собой большинство из этих двух элементов в воздухе, являются переменными компонентами. Сера, фосфор и все другие элементы присутствуют в значительно меньших количествах.
Согласно графику кривой содержания (вверху справа), аргон, значительный, если не главный компонент атмосферы, вообще не появляется в коре. Это связано с тем, что атмосфера имеет гораздо меньшую массу, чем кора, поэтому аргон, остающийся в коре, мало влияет на ее массовую долю, в то время как в то же время накопление аргона в атмосфере стало достаточно большим, чтобы быть значительным.
Городские почвы
Полный список содержания элементов в городских почвах см. В разделе Содержание элементов (страница данных) # Городские почвы .
Источник