Второй закон термодинамики. Энтропия



Второй закон определяет, какие из процессов в рассматриваемой системе при заданных температуре, давлении, концентрациях могут протекать самопроизвольно,то есть без затраты работы извне; каково количество работы, которая может быть получена при этом, и каков предел возможного самопроизвольного течения процессов.
Несамопроизвольные процессы не могут осуществляться без воздействия извне, само воздействие извне может быть в виде передачи системе энергии из окружающей среды (переход тепла от холодного тела к горячему — процессы в холодильнике).
В отличие от первого закона термодинамики, второй закон обладает более ограниченной областью применения, он носит статистическийхарактер, то есть, применим к системам из большого числа частиц, поведение которых может быть выражено законами статики.
Чем больше тепла выделяется при экзотермических реакциях, тем большим сродством друг к другу обладают реагирующие вещества, тем прочнее связи в полученных продуктах. В обратном направлении процесс может пойти лишь при сообщении системе тепла извне.
Для любой термодинамической системы при данных условиях её существования всегда имеется некоторый общий критерий, которым характеризуется возможность, направление и предел самопроизвольного протекания процессов. Для изолированных систем критерием является энтропия (S).Термин был введен Рудольф Клаузиусом (1822-1888).
Любая система стремится к уменьшению величины ∆H и увеличению величины ∆S. Второй закон термодинамики устанавливает, чтов изолированных системах самопроизвольно могут совершаться только такие процессы, при которых энтропия системы возрастает, и процесс может идти самопроизвольно до такого состояния, при котором энтропия обладает максимальным для данных условий значением.
Изменение энтропии в процессе зависит от начального и конечного состояний и не зависит от пути перехода
Энтропия— термодинамическая функция, которая характеризует меру упорядоченности системы или меру беспорядка.
Изменение энтропии ∆S наиболее просто определяется для обратимых изотермических процессов, оно равняется тепловому эффекту процесса, делённому на абсолютную температуру 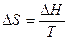
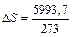
Отсюда следует, что в любых изолированных системах(а в них могут совершаться только адиабатные процессы) энтропия системы сохраняет постоянное значение. Следовательно, в изолированных системахвсякий самопроизвольно протекающий процесс сопровождается возрастанием энтропии. В случае закрытых систем энтропия в ходе процесса может, как увеличиваться, так и уменьшаться. Процессы для которых: 1) ∆S > 0 — расширение газов, фазовые превращения из твердого к жидкому и газообразному состоянию, растворение кристаллических веществ; 2) ∆S
Установление статистической природы второго закона дало возможность Л. Больцману в 1896 г. определить статистический смысл энтропии
где kБ — постоянная Больцмана — kБ = R/NA; W- термодинамическая вероятность данного состояния системы. Термодинамическая вероятность — это число микросостояний, через которые может быть реализовано данное микросостояние. Энтропия является мерой вероятности состояния системы.
Статистическая термодинамика показывает, что энтропия может рассматриваться как сумма составляющих, относящихся к различным формам движения частиц. Различают следующие составляющие энтропии: энтропия поступательного движения молекул Sпост.; энтропия вращательного движения молекул Sвращ. ; энтропия вращательного движения атомов и атомных групп, содержащихся в молекуле, Sвн.вращ. (энтропия внутреннего вращения); энтропия колебательного движения атомов и атомных групп, содержащихся в молекуле,Sкол;; и энтропия движения электронов Sэл

Энтропия зависит от всех видов движения частиц, содержащихся в молекуле, и возрастает при всех процессах, вызываемых движением частиц: испарение, плавление, растворение, диффузия, расширение газа; возрастает при ослаблении связей между атомами в молекулах и при разрыве связей, то есть при диссоциации молекул. Наоборот, при упрочнении связей энтропия уменьшается, то есть при кристаллизации, конденсации, сжижении газов.
Энтропия увеличивается с повышением температуры и уменьшается с повышением давления. В ряду однотипных соединений абсолютная энтропия растет по мере усложнения атомов, входящих в состав молекул, а также по мере усложнения состава молекул.
| Вещество | S о 298, Дж/моль∙К | Вещество | S о 298, Дж/моль∙К |
| HF | 173,5 | CuO | 43,5 |
| HCl | 186,4 | Cu2O | 100,7 |
| HBr | 198,1 | CO | 197,7 |
| CO2 | 213,6 |
Чем больше твердость вещества, тем меньше его энтропия. Например: графит — S о 298 = 5,74 Дж/моль∙К, алмаз — S о 298 = 2,37 Дж/моль∙К. Энтропия в аморфном и стеклообразном состоянии больше, чем в кристаллическом. Энтропия возрастает с увеличением дисперсности частиц вещества.
Источник
Второе начало термодинамики: вечный двигатель второго рода и тепловая смерть Вселенной
- 12 Январь 2021
- 14 минут
- 12 878
Пришла пора разобраться со вторым фундаментальным постулатом термодинамики, который именуется второе начало термодинамики. Второе начало не является доказуемым в рамках классической термодинамики. Его формулировки – результат обобщения опытов, наблюдений и экспериментов. Попытаемся рассказать о нем кратко и понятно.
В прошлой статье по термодинамике мы говорили о термодинамических системах, состоящих из большого числа частиц. Для описания подобных систем используются так называемые функции состояния.
Термодинамическая функция состояния (или термодинамический потенциал) – это функция, зависящая от нескольких независимых параметров, определяющих состояние системы. Чтобы было понятнее, приведем пример. Одна из функций состояния системы – это ее внутренняя энергия. Она не зависит от того, как именно система оказалось в данном состоянии
Энтропия
Еще одно понятие, с которым нужно познакомиться – это энтропия. Для понимания второго начала термодинамики энтропия очень важна. А еще это красивое слово, которое многих ставит в ступор и которым можно блеснуть в компании.
В самом общем случае, энтропия – мера хаотичности некоторой системы
Простой пример : представим, что у вас есть ящик с носками. Если все носки в ящике разбросаны и валяются вперемешку и по одному, энтропия такой системы максимальна. А если носки собраны по парам и лежат аккуратненько в рядок — минимальна.
В термодинамике, энтропия – это функция состояния термодинамической системы, которая определяет меру необратимого рассеивания энергии. Что это значит? Это значит, что какая-то часть внутренней энергии системы не может перейти в совершаемую системой механическую работу. Например, процесс преобразования теплоты в механическую работу всегда сопровождается потерями, в результате которых теплота трансформируется в другие виды энергии.
Энтропия при необратимых термодинамических процессах увеличивается, а при обратимых – остается постоянной. Математическая запись энтропии (S):
Здесь дельта Q – количество теплоты, подведенное или отведенное от системы, T – температура системы, dS – изменение энтропии.
Существует несколько различных формулировок второго начала термодинамики, и вот одна из них:
Энтропия замкнутой системы возрастает при любых необратимых процессах в этой системе
Так как нас интересует именно понимание сути вещей, приведем еще одно самое простое определение:
Невозможен процесс, единственным результатом которого является передача энергии в форме теплоты от холодного тела к горячему
К слову, данная формулировка второго начала термодинамики принадлежит Рудольфу Клаузиусу, который и ввел в обиход понятие энтропии.

И снова вечный двигатель
После разочарования с идеей вечного двигателя первого рода люди и не думали сдаваться. Через какое-то время был придуман вечный двигатель второго рода, работа которого основывалась на передаче тепла и не перечила закону сохранения энергии. Такой двигатель преобразует все тепло, полученное от окружающих тел, в работу. Например, в качестве его реализации предполагалось путем охлаждения океана получить огромное количество теплоты. Но к счастью до охлаждения океана и заморозки рыб дело не дошло, т.к. данная идея противоречит второму началу динамики. КПД любой машины не может быть равен единице, также как тепло не может быть преобразовано в работу полностью. Так что сколько ни старайтесь, а вечный двигатель второго рода создать невозможно, так же как и вечный двигатель первого рода.
Тепловая смерть Вселенной
После введения Рудольфом Клаузиусом понятия энтропии в 1865 году возникло множество споров, домыслов и теорий, связанных с этим понятием. Одна из них – гипотеза о тепловой смерти Вселенной, сформулированная самим Клаузиусом на основе второго начала термодинамики.

Данная теория, сформулированная Клаузиусом, гласит, что Вселенная, как любая замкнутая система, стремится к состоянию термодинамического равновесия, характеризующемуся максимальной энтропией и полным отсутствием макроскопических процессов, что в свою очередь обессмысливает привычное нам понятие времени. По Клаузиусу: «Энергия мира остается постоянной. Энтропия мира стремиться к максимуму». Это означает, что когда Вселенная придет в состояние термодинамического равновесия, все процессы прекратятся и мир погрузиться в состояние «тепловой смерти». Температура в любой точке Вселенной будет одной и той же, более не будет каких-либо причин, способных вызвать возникновение каких бы то ни было процессов.
Концепция тепловой смерти вселенной еще в недалеком прошлом была довольно широко распространена и являлась предметом активных дискуссий. Так, в книге Джинса «Universe around us» (1932г.) можно найти следующие строки касательно тепловой смерти Вселенной: «Вселенная не может существовать вечно; рано или поздно должно наступить время, когда ее последний эрг энергии достигнет наивысшей степени на лестнице падающей полезности, и в этот момент активная жизнь Вселенной должна будет прекратиться».

При выводе своей теории Клаузиус прибегал в своих рассуждениях к следующим экстраполяциям (приближениям):
- Вселенная рассматривается как замкнутая система.
- Эволюция мира может быть описана как смена его состояний.
Интересный факт : рассуждения о тепловой смерти позволили церкви заявить, что с научной точки зрения (в том числе и благодаря теории Клаузиуса) можно найти предпосылки, указывающие на существование бога. Так, в 1952 году на заседании «папской академии наук» папа Пий 12-й в своей речи сказал: «Закон энтропии, открытый Рудольфом Клаузиусом, дал нам уверенность, что спонтанные природные процессы всегда связаны с некоторой потерей свободной, могущей быть использованной энергии, откуда следует, что в замкнутой материальной системе в конце концов эти процессы в макроскопическом масштабе когда-то прекратятся. Эта печальная необходимость. красноречиво свидетельствует о существовании Необходимого Существа».
Опровержение теории тепловой смерти Вселенной
Как уже отмечалось выше Клаузиусом, при выводе его теории применялись определенные экстраполяции. Сегодня несмотря на некоторые сложности можно с уверенностью сказать, что подобные выводы являются антинаучными. Дело в том, что существуют определенные границы применимости второго начала термодинамики: нижняя и верхняя. Так, второе начало термодинамики не может быть применено для описания микросистем, размеры которых сравнимы с размерами молекул, и для макросистем, состоящих из бесконечного числа частиц, т.е. для Вселенной в целом.

Собственно первым ученым, установившим статистическую природу второго начала термодинамики и противопоставившим теории тепловой смерти Вселенной так называемую флуктуационную гипотезу, был выдающийся физик-материалист Больцман. Имеет место формула Больцмана, позволяющая дать статистическое истолкование второму началу термодинамики
Здесь S – энтропия системы, k – постоянная Больцмана, P – термодинамическая вероятность состояния, определяющая число микросостояний системы, соответствующих данному макросостоянию. Согласно формуле Больцмана,
То есть термодинамическая вероятность состояния изолированной системы при всех происходящих в ней процессах не может убывать. Однако т.к. для систем, состоящих из бесконечного числа частиц, все состояния будут равновероятными , вышеописанное соотношение неприменимо ко Вселенной. В подобных системах имеют место значительные флуктуации (флуктуация – отклонение истинного значения некоторой величины от ее среднего значения), представляющие собой отклонения от второго начала термодинамики. Согласно Больцману, состояние термодинамического равновесия представляет собой лишь наиболее часто встречающееся и наиболее вероятное; наряду с этим в равновесной системе могут самопроизвольно возникнуть сколь угодно большие флуктуации. То есть во Вселенной, находящейся в состоянии термодинамического равновесия, постоянно возникают флуктуации, причем одной такой флуктуацией является та область пространства, в которой находимся мы.

Современный подход безусловно отвергает теорию тепловой смерти Вселенной. Учитывая огромный возраст Вселенной и тот факт, что она не находится в состояние тепловой смерти, можно сделать вывод о том, что во Вселенной протекают процессы, препятствующие росту энтропии, т.е. процессы с отрицательной энтропией. Однако выводам Больцмана о том, что во Вселенной преобладает состояние термодинамического равновесия, все более противоречит растущий экспериментальный материал астрономии. Материя обладает никогда не утрачиваемой способностью к концентрации энергии и превращения одних форм движения в другие. Так, например, процесс образования из рассеянной материи звезд подчиняется определенным закономерностям и не может быть сведен исключительно к случайным флуктуациям распределения энергии во Вселенной.
Дорогие друзья! Сегодня мы по возможности выяснили, какой смысл имеет понятие энтропии для второго начала термодинамики, узнали, что вечный двигатель второго рода невозможен, а также порадовались, что тепловой смерти Вселенной все-таки не случится. Мы как всегда надеемся на то, что вам понравилась наша статья, в которой мы старались рассказать о термодинамике просто, понятно и интересно. Желаем успехов в учебе и напоминаем – подсказать, помочь, проконсультировать и взять часть нагрузки на себя всегда готовы наши специалисты. Учитесь и живите в свое удовольствие!
Иван Колобков, известный также как Джони. Маркетолог, аналитик и копирайтер компании Zaochnik. Подающий надежды молодой писатель. Питает любовь к физике, раритетным вещам и творчеству Ч. Буковски.
Источник



