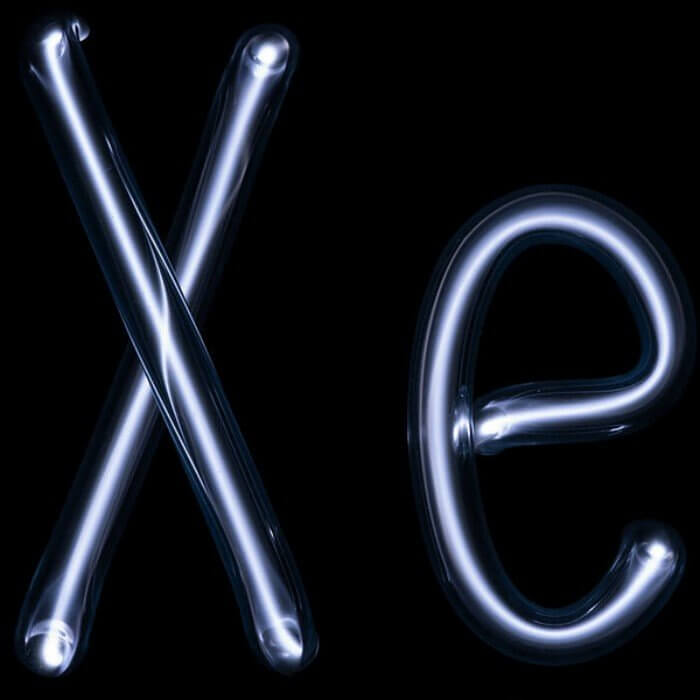У черных дыр нашли способность создавать гигантские «цунами»
Рядом со сверхмассивными черными дырами могут образовываться массивные, похожие на цунами структуры, которые представляют собой потоки масс из газа, сбежавшие от интенсивного гравитационного притяжения черной дыры. К такому выводу пришли ученые, проведя компьютерное моделирование для моделирования окружающей среды вокруг сверхмассивных черных дыр в космосе, пишет портал Space.com.
Более того, согласно предположениям исследователей, сверхмассивные черные дыры могут порождать самые большие вихреобразные структуры во Вселенной.
Пристальное внимание в ходе научной работы было уделено странной среде вокруг сверхмассивных черных дыр и особенностям взаимодействия в ней газов и радиации. Так, ученые заметили, что достаточно далеко от сверхмассивной черной дыры могут начать формироваться волны газа и вещества, которые могут перерасти в массивные цунами. Эти закрученные газовые волны могут простираться на расстояние до 10 световых лет над диском. Причем после образования структуры больше не находятся под влиянием гравитации черной дыры.
Свою роль в образовании таких газовых вихрей играет яркое рентгеновское излучение, которое вблизи черной дыры проникает в карманы горячего газа во внешней атмосфере диска. Пузыри горячей плазмы расширяются, охлаждаясь по краям диска, помогая создавать структуры, похожие на цунами.
Сейчас ученым предстоит подтвердить их выводы при помощи телескопических наблюдений.
Источник
Самый легкий газ в мире и его характеристики
Газ – одно из агрегатных состояний веществ. В таком виде они чаще всего существуют во Вселенной, образуя туманности, звезды и межзвёздное вещество. Без газов не обходится и Земля. Они входят в состав воздуха, присутствуют в живых организмах. А какой газ самый лёгкий? Какими особенностями он обладает? Давайте это выясним.
Самый лёгкий газ
Химический элемент, молекулы которого образуют легчайший газ – это водород. В периодической системе он обозначается символом H и стоит на первом месте. Он уникален по своей природе, ведь может быть опасен, но вместе с тем он крайне необходим любому живому существу.
Водород – самый лёгкий газ, когда два его атома соединяются в молекулу, образуя H2. По легкости он превосходит воздух в 14,5 раз. В смеси с кислородом или воздухом он может взрываться. Но если соединить два его атома с атомом оксигена, то получится обыкновенная вода, в которой мы так нуждаемся. На это указывает и его латинское название Hydrogenium, что можно перевести как «порождающий воду».
Если соединить два атома водорода и два атома кислорода, то выйдет уже другое вещество. Они образуют перекись водорода – бесцветную жидкость, которую используют для обеззараживания ран, отбеливания волос, а также в качестве ракетного топлива.
Состояния и свойства вещества водорода
Самый легкий химический газ при нормальных условиях не обладает цветом, вкусом и запахом. Его плотность на один кубический сантиметр составляет всего 0,0000899 грамма. Температура его кипения — 252,6 °С. В свободном состоянии в природе он встречается именно в виде газа H2.
Водород прекрасно растворяется во многих металлах (в палладие, титане, ниобие, платине, никеле), диффундируя с ними. Он также растворим в этаноле, а вот с серебром не смешивается.
Он обладает высокой теплопроводностью, которая в семь раз выше, чем у воздуха. Жидкий водород лёгкий и тоже бесцветный. При сжижении его объём уменьшается, а вещество приобретает криогенные свойства. В таком виде он опасен для человека – может вызвать обморожение кожи, а его пары вызывают отёк лёгких.
В твёрдом состоянии вещество выглядит как снегоподобная масса белого цвета. Она плавится при температуре −259,2 °C, и обладает практически самой маленькой плотностью среди твёрдых простых веществ — 0,08667 г/см³. При давлении 300 Гпа он переходит в металлическое состояние. Предполагается, что металлический водород есть в ядрах некоторых планет, например Сатурна и Юпитера.
Реакции с водородом
Сам по себе самый лёгкий газ неактивный. Однако при нагревании он способен вступать в реакции с различными веществами, например азотом, кислородом, серой и т. д. Горение водорода сопровождается выделением воды, это в XVIII веке обнаружил ещё химик Лавуазье, который и дал газу его название.
Смешиваясь с кислородом, происходит его окисление. Но при обычной температуре реакция протекает медленно и малозаметна со стороны. Тем не менее, смесь прозвали «гремучей», так как при нагревании она взрывается, сопровождаясь громким хлопком. Чтобы активировать смесь достаточно даже одной искры.
С участием света и тепла реагирует со многими металлами и неметаллами. С хлором образует хлороводород – устойчивый газ с ярко выраженным запахом. Он растворяется в воде и дымится на влажном воздухе. С азотом образует аммиак, с серой – сильно пахнущий сероводород.
При обычных температурах самый лёгкий газ реагирует только фтором и с очень активными, щелочными металлами, например, кальцием. С фтором он очень взрывоопасен, и вступает в реакцию даже при нулевой температуре и в темноте.
С оксидами он отнимает кислород и ведет себя как восстановитель. Так, из CuO на выходе образуется медь и вода, а из WO3 – вольфрам и 3H2O.
Распространение в природе
Водород – самый распространённый элемент во Вселенной, но на Земле он уступает первенство кислороду. В космосе самый лёгкий газ присутствует в межзвёздном веществе, образует туманности, звёзды и ядра планет.
На Солнце и других звездах температура слишком высокая, поэтому водород становится плазмой. С его помощью в них происходят термоядерные реакции, сопровождающиеся выделением огромного количества энергии. Именно сжигание водорода и его превращения позволяют звездам светить и отдавать тепло.
На Земле водород находится преимущественно в связанном виде. В свободном состоянии в сухом воздухе содержится только 0,00005 % этого газа. Он присутствует почти во всех живых клетках. Так, около 64% атомов в организме приходится на водород. Он входит в состав белков, жиров, гормонов и других соединений.
Где его применяют?
Когда-то самый лёгкий газ использовали для поднятия в воздухе воздушных шаров и дирижаблей. Однако это не было безопасным. Если каким-то образом к нему поступал кислород, установка загоралась. Из-за возгорания самого крупного дирижабля «Гинденбурга» в 1937 году погибло 35 человек. После этого опасный газ заменили гелием.
Сейчас из водорода делают хлороводород и соляную кислоту, а также аммиак, необходимый для производства удобрений. С помощью него изготавливают мыло, пластмассы. Соединяя его с CO2, получают синтез-газ, для производства энергии. Пропуская через него жидкие растительные жиры, получают твердые, из которых делают маргарин.
Восстановительные качества водорода помогают получать чистые металлы из их оксидов (медь, вольфрам, молибден и т. д.). При его горении образуются очень высокие температуры (3000-4000 градусов), с их помощью варят тугоплавкие металлы.
Эффективное топливо
Водород обладает высокой теплотой сгорания и не представляет вред для окружающей среды Когда он горит, то в атмосферу выделяются кислород и вода. Он вполне мог бы заменить дорогие нефть и газ, тяжело добываемый уголь, а также остановить выделение вредного углекислого газа, которое неизбежно при их переработке.
Над этим вопросом сейчас и задумываются учёные. Программы по водородной энергетики уже озвучили Исландия, США, Япония, ЮАР, Индия, Южная Корея. В Италии компания Enel уже запустила электростанцию на этом газе, Япония заявила, что откроет свою станцию в 2018 году. Автомобильные компании уже давно представили свои водородные модели.
Возможно, такое топливо могло бы решить некоторые проблемы. Однако оно может породить и новые. Пока неизвестно, как эффективно получать водород, затрачивая минимум средств и не нарушая природный баланс. Поэтому все идеи об использовании самого легкого газа находятся в разработке.
Источник
Почему некоторые газы называются «благородными»?
Даже если вы очень далеки от химии, скорее всего, вы хотя бы раз в своей жизни могли услышать выражение «благородные газы». К ним относятся всем известные неон, криптон, аргон, ксенон, гелий и радон. Так почему же именно газы стали называться благородными? И в чем же именно заключается их благородство? Давайте попробуем разобраться вместе.
Благородных газов в природе всего 6: Неон, Криптон, Аргон, Ксенон, Гелий и Радон
Что такое инертные газы?
Благородные газы, известные в химии благодаря своему уникальному свойству не смешиваться с другими веществами, также часто называют инертными. Как можно судить из названия, “благородство” инертных газов не позволяет им взаимодействовать с более простыми субстанциями и даже друг с другом. Такая избирательность благородных газов вызвана их атомным строением, которое проявляется в замкнутой внешней электронной оболочке, не позволяющей радону, гелию, ксенону, аргону, криптону и неону обмениваться своими электронами с атомами других газов.
Самым распространенным инертным газом в природе считают аргон, который занимает почетное третье место по содержанию в атмосфере Земли после азота и кислорода. У аргона нет вкуса, запаха и цвета, однако именно этот газ считается одним из самых распространенных во Вселенной. Так, наличие этого газа наблюдается даже в некоторых планетарных туманностях и в составе некоторых звезд.
При нагревании в газоразрядной трубке аргон приобретает розовый оттенок
Самым редким благородным газом в природе считают ксенон, который несмотря на свою редкость, содержится в атмосфере Земли наряду с аргоном. Ксенон обладает наркотическими свойствами и часто применяется в медицине в качестве анестезирующего средства. Кроме того, согласно данным Всемирного антидопингового агентства, ингаляции этого редкого газа имеют допинговый эффект, влияющий на физическое состояние применяющих его спортсменов. Заполнение ксеноном легких человека приводит к временному понижению тембра голоса, что является эффектом, обратным применению гелия.
При нагревании ксенон светится фиолетовым цветом
Четверо остальных благородных газов — Радон, Гелий, Неон и Криптон — также обладают своими уникальными свойствами. Все они не имеют какого-либо специфического вкуса, запаха или цвета, однако присутствуют в атмосфере Земли в небольших количествах и важны для нашего дыхания. Так, гелий считается одним из самых распространенных элементов в космосе, а его наличие в атмосфере Солнца, в составе других звезд Млечного Пути и некоторых метеоритов подтверждено научными данными.
Если вам нравится данная статья, приглашаю вас присоединиться к нашему каналу на Яндекс.Дзен, где вы сможете найти еще больше полезной информации из мира популярной науки и техники.
Неон, светящийся при нагревании красноватым оттенком, получается из воздуха при его глубоком охлаждении. Из-за сравнительно небольшой концентрации этого инертного газа в атмосфере планеты, неон чаще всего получают в качестве побочного продукта при добыче аргона.
Радон — радиоактивный инертный газ, который может представлять опасность для человеческого здоровья. Газообразный радон способен светиться голубым или синим светом, постепенно облучая человека и даже приводя к онкологическим заболеваниям. Несмотря на это, в медицине часто применяются так называемые радоновые ванны, которые позволяют добиться положительного эффекта при лечении болезней центральной нервной системы.
Радоновое озеро в селе Лопухинка Ленинградской области
И наконец, последний благородный газ, который можно найти в природе — криптон. Это один из самых редких благородных газов во Вселенной. В отличии от остальных инертных газов, этот газ при определенных условиях может испускать резкий запах, схожий с запахом хлороформа. Воздействие криптона на человека и животных крайне мало изучено из-за невероятной редкости этого газа.
Где применяются благородные газы?
Самыми применяемыми человеком инертными газами считаются аргон, гелий и неон, которые используются повсеместно от физики до медицины. Так, гелий используется при сварке металлов и в качестве хладоносителя при проведении лабораторных экспериментов. Неон и аргон часто применяются при изготовлении ламп накаливания и в металлургии, при изготовлении алюминиевых сплавов.
Благодаря своим уникальным свойствам, благородные газы нашли свое применение в разных отраслях науки
Остальные благородные газы чаще всего используются в медицине. Как уже упоминалось выше, радон находит свое применение в медицине, а ксенон и криптон используются в качестве наполнителя осветительных ламп.
Новости, статьи и анонсы публикаций
Свободное общение и обсуждение материалов
Наука постоянно демонстрирует нам интересные вещи. По мере того как мы движемся в светлое будущее, научные достижения начинают граничить с магией. Наука пост…
В сентябре 2011 года физик Антонио Эредитато поверг мир в шок. Его заявление могло перевернуть наше понимание Вселенной. Если данные, собранные 160 учеными п…
Не так давно стэнфордские инженеры изобрели революционный материал для покрытия, который может помочь охладить здания даже в солнечные дни, отражая тепло от …
Источник
Это должен знать каждый. Удивительный гелий.
Каждый из нас знаком с этим удивительным веществом. Кто- то вдыхал его и при этом веселил окружающих своим изменившимся голосом. А шары , наполненные гелием — любимая игрушка всей детворы и символ свободы для выпускников школ. Но кроме этих знакомых всем свойств, гелий обладает массой уникальных особенностей.
Гелий — второй химический элемент Периодической системы Д.И. Менделеева. Обнаружен он был 18 августа 1868 года французским ученым Пьером Жансеном и 20 октября того же года английским астрономом Норманом Локьером. Они изучали корону Солнца и в спектре обнаружили ярко- желтую линию до того момента никому неизвестного химического элемента.Локьер с Франклендом назвали его гелий (от греческого «гелиос» — солнце).
В 1895 году шотландец Уильям Рэмси открыл гелий и на Земле, а затем было доказано его наличие в атмосфере.
Почему с гелием так трудно работать, почему его так трудно обнаружить. Все дело в том, что гелий относится к группе инертных газов.
Эти газы, из- за того, что у них определенное число электронов не взаимодействуют с другими веществами и химическими элементами.
Гелий самый неактивный элемент во Вселенной. Повторюсь самый неактивный. Его электронная оболочка, состоящая всего из двух электронов заполнена. Ему не надо «чужих» электронов и свои он тоже не отдает. Чтобы заставить гелий соединиться с другим химическим элементом нужны экстремальные давления и температуры.
Гелий, после водорода, самый распространенный элемент во Вселенной. Он появляется в процессе термоядерного синтеза из водорода в глубинах звезд. На долю водорода и гелия приходится 99,9 % всего вещества нашей Вселенной.
Он не имеет ни цвета, ни вкуса, ни запаха.
Но самые удивительные свойства проявляются у гелия, если его перевести в жидкое состояние. Это возможно только при температурах близких к абсолютному нулю. Жидкий гелий ведет себя аномально, у него нет вязкости, и он может беспрепятственно перетекать в любых направлениях. Такие жидкости получили название квантовых.
Гелий в основном используется в металлургической промышленности, при воздухоплавании, и как все инертные газы светится при пропускании через него электрического тока.
Так что, такой веселый газ играет огромную роль в глобальных процессах нашей Вселенной.
Источник